印度仿制药巨头入华,一系列药监和集采新政改革也在为进口仿制药进入中国市场吹着阵阵“东风”。行业“狼来了”?还是狼,真的来了?
仿制药巨头设立合资公司
7月16日,印度仿制药巨头西普拉(Cipla)欧洲分公司CiplaEU宣布,将与江苏创诺制药有限公司成立合资公司,作为西普拉在华的分公司,主要业务领域是西普拉最擅长的呼吸领域产品。按照协议,双方共同投资3000万美元,其中西普拉欧洲分公司持股80%,江苏创诺制药持股20%。
作为印度第二大仿制药企,西普拉目前旗下产品包括易瑞沙、格列卫、特罗凯等在内的一批知名抗癌药。但截至目前,其在中国市场所经营的产品则非常有限,仅有拉米夫定。
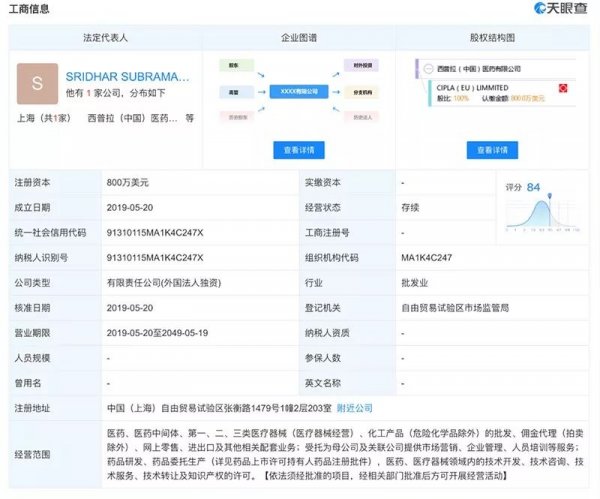
根据天眼查显示,今年5月20日,西普拉已经在上海自贸区市场监管局备案,并同时设立了办事处。
业内此前一直有传闻称,印度仿制药企业准备参与中国“4+7”的竞标,最近的一次会议,更是大大增加了市场上对于印度药企要来分一杯羹的担忧。
一个月前,国家药监局、印度中央药物标准控制局召开了“中印药品监管交流会”。参与会议的,不仅有两国的药监部门,更有发改委、商务部、国家医保局、上海市药品监督管理局、中国医药保健品进出口商会、印度卫生和家庭福利部、印度商务部、印度驻华大使馆、印度驻上海总领事馆等相关部门,以及来自中国和印度制药协会和企业的百余人。
仿制药大国一直想入华
作为有“世界药房”之称的仿制药大国,印度生产了全球20%的仿制药,药品出口到200多个国家。
因为对中国市场巨大潜力的渴望,印度药企其实一直在努力尝试进入中国市场,近年来更是加快了步伐。
2018年7月,印度第二大制药公司安若维他投资1亿美元设立安若维他药业泰州有限公司;2018年12月,印度阿拉宾度制药与罗欣药业达成合作,共同在中国设立合资公司,联合投资研发和生产体系以引进呼吸领域产品;2019年2月,印度药企瑞迪博士的硫酸氢氯吡格雷片申请了生物等效性试验,为进入中国市场作准备。此外,阿拉宾度、瑞迪、太阳制药等印度大型药企均陆续在进行中国的药品申报。
制度问题一直是印度仿制药入华的最大障碍:进口仿制药实施的是临床审批制,一款仿制药的一致性评价需要数年时间。
随着加速审评审批、取消抗癌药关税等一系列对跨国药企的利好政策出台,此前掣肘跨国药企的因素,正在被逐渐降低。中国加入ICH之后,进口原研药、进口仿制药获批加快更是成为水到渠成的事情。2018年底,国内临床试验默许制实施,进口仿制药也进入备案制时代。
冲击还是机遇?
一旦印度仿制药企入华,将对我国药企带来冲击还是机遇?
某上市药企管理人员表示,印度药无疑将倒逼本土仿制药提升质量和降低价格,将成为刺激本土仿制药产业升级的动力之一。
但有投行人士分析称,印度仿制药进入中国之路未必顺利。
首先,其质量问题一直是各国药监机构考虑的重要问题。例如近几个月,FDA就发布了多个公告,指出太阳制药、Luptin等印度知名药企存在生产质量问题。
其次,印度药审批通过进入中国之后,药企还需逐步开发医院等销售渠道。目前,印度药企在中国几乎没有大规模销售能力,除了药品成本,后期维护等的运营成本也非常大,最终价格未必会比国内的仿制药低。
无论如何,印度药企入华,都将成为被扔进鱼群中的那条“鲶鱼”。我国药企必须从产品立项、原料药和辅料供应、生产效率、销售覆盖能力等多方面综合考虑应对措施。印度药企如果入华,带来的将不仅仅是仿制药,同时还有原料药的竞争。 | 

